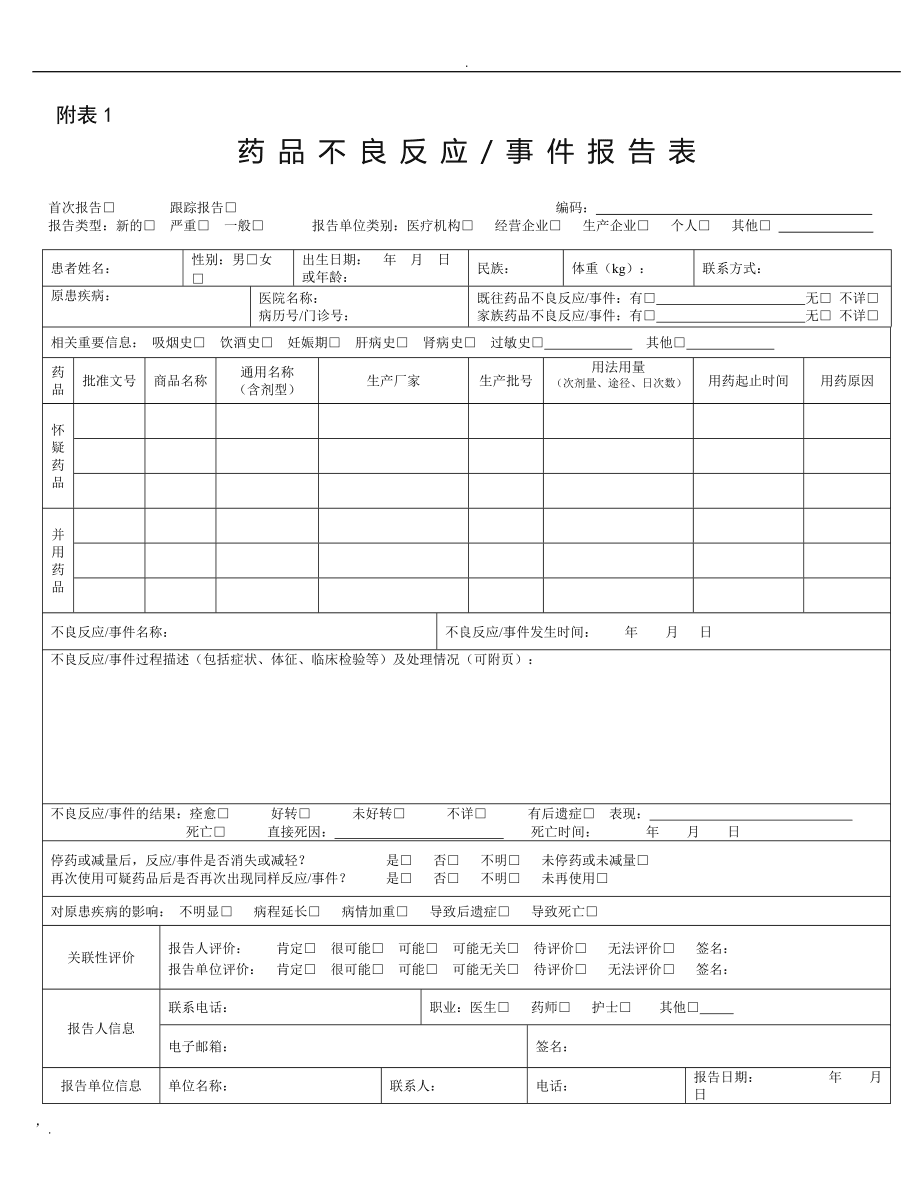
新版GCP第二十六条研究者的安全性报告应该符合以下要求:
除试验方案或则其他文件(如研究者指南)中规定不需立刻报告的严重不良风波外,研究者应该立刻向申办者书面报告所有严重不良风波,随后应该及时提供详细、书面的随访报告。严重不良风波报告和随访报告应该标明受试者在临床试验中的鉴认代码,而不是受试者的真实姓名、公民身分号码和住址等身分信息。试验方案中规定的、对安全性评价重要的不良事件和实验室异常值,应当根据试验方案的要求和期限向申办者报告。
涉及死亡风波的报告,研究者应该向申办者和伦理委员会提供其他所须要的资料,如尸检报告和最终医学报告。
研究者收到申办者提供的临床试验的相关安全性信息后应该及时签收阅读,并考虑受试者的医治,是否进行相应调整,必要时尽快与受试者沟通,并应该向伦理委员会报告由申办方提供的可疑且非预期严重不良反应。
临床试验不良事件上报流程图,下面让我们一起来看一下具体如何操作的!